アンモニアとは何か
アンモニア(NH₃)は、現代の化学工業において極めて重要な化学物質の一つであり、その用途の広さから「産業の基礎化学物質」とも呼ばれます。
無色で特有の強い刺激臭を持つ気体であり、化学式NH₃で表されます。
アンモニアは、水に非常によく溶ける性質を持ち、その際にアンモニア水(NH₃(aq))を形成します。
このアンモニア水は、弱アルカリ性を示し、さまざまな化学反応の触媒や試薬として広く使用されています。
また、農業においては窒素肥料の主要な原料であり、作物の成長を促進するために不可欠な存在です。
さらに、冷媒やエネルギー資源としても利用され、持続可能なエネルギーへの移行が進む中で、注目されるべき素材の一つとなっています。
アンモニアの定義と化学式
アンモニアは、窒素と水素の化合物であり、化学式はNH₃です。
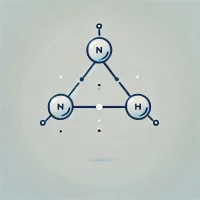
窒素原子を中心に、三つの水素原子が三角錐形に配置されており、この立体構造は、窒素上に孤立電子対が存在することに起因しています。
この孤立電子対は、アンモニア分子が極性を持つ原因となり、他の化学物質との結合や反応性に大きく影響を与えます。
物理的な特性として、アンモニアは常温常圧で無色透明の気体であり、密度は0.6942 g/Lです。
これは、空気の密度よりも軽いため、収集する際には上方置換法がよく用いられます。
また、アンモニアは融点が -77.73°C、沸点が -33.34°Cと低く、液化するためには低温が必要です。
そのため、冷凍技術や冷媒としての利用価値が高く、特に産業用の冷却システムで広く使われています。
化学的な特性としては、アンモニアは弱塩基であり、酸と反応してアンモニウム塩を形成します。
例えば、塩酸(HCl)と反応させると塩化アンモニウム(NH₄Cl)が生成されるため、化学実験においては基本的な試薬として頻繁に使用されます。
また、アンモニアは金属錯体の配位子としても重要な役割を果たし、金属イオンと結合することで安定な錯体を形成する性質を持っています。
この特性は、化学工業での触媒反応や材料科学の分野での応用に不可欠です。
アンモニアの由来と歴史
アンモニアという名称は、古代エジプトのリビア砂漠にある「アモン神殿」に由来しています。
この地域では、古代の人々が「アモンの塩」と呼ばれる塩化アンモニウム(NH₄Cl)を採取しており、その塩は祈りや儀式の一部として使用されていました。
このことが「アンモニア」の名称の起源となり、ラテン語で「sal ammoniacum(アモンの塩)」と呼ばれるようになったのです。
化学的な視点から見ると、アンモニアは18世紀の科学者ジョゼフ・プリーストリーによって初めて合成されました。
1774年、彼はアンモニアの存在を確認し、その化学的特性を研究することで、アンモニアが独立した化合物であることを明らかにしました。
19世紀に入ると、アンモニアの合成方法はさらに改良され、特にフリッツ・ハーバーとカール・ボッシュによって確立された「ハーバー・ボッシュ法」は、アンモニアの大量生産を可能にしました。
この方法では、窒素(N₂)と水素(H₂)を高温・高圧下で鉄触媒を用いて反応させることで、アンモニアを合成します。
ハーバー・ボッシュ法の発明は、20世紀の化学工業に革命的な影響を与えました。
それまで、窒素肥料の生産は自然の供給に依存していましたが、この技術により工業的な窒素肥料の大量生産が可能となり、農業の効率を劇的に向上させることができました。
この成果は、「緑の革命」と呼ばれる農業生産性の向上に直接的に寄与し、世界の食糧供給を支える基盤となったのです。
さらに、アンモニアは工業用の冷媒としても利用され、冷凍技術の進展とともに広く普及しました。
現在では、アンモニアはカーボンニュートラルなエネルギー資源としての研究も進んでおり、再生可能エネルギーを用いた「グリーンアンモニア」の開発が注目されています。
この技術が実現することで、持続可能な社会への貢献が期待されており、アンモニアの可能性はますます広がっています。
アンモニアの物理的・化学的性質
アンモニアは、現代の化学工業やさまざまな産業で不可欠な物質であり、その物理的および化学的性質が応用範囲の広さを支えています。
ここでは、アンモニアの基本的な性質を詳しく見ていき、その特徴がどのように利用されているかについて解説します。
アンモニアの物理的特性
アンモニア(NH₃)は、常温常圧で無色の気体であり、特有の強い刺激臭を持っています。
この臭いは、アンモニアの漏洩を迅速に検知するのに役立つ特徴で、工業的にも安全管理の観点から重要視されています。
融点と沸点
アンモニアの融点は -77.73°C、沸点は -33.34°Cです。
この低い融点と沸点のため、アンモニアは常温で気体の状態を保つために特殊な保管が必要です。
また、冷媒としての利用も可能で、低温環境を作り出すために液化アンモニアが広く使用されています。
水への溶解度
アンモニアは水に非常によく溶ける性質を持ち、0°Cの水100mLに対して89.9gものアンモニアが溶解します。
この高い溶解性は、アンモニア分子が極性を持ち、水分子との間で強力な水素結合を形成するためです。
このため、アンモニアは水と容易に反応し、アンモニア水(NH₃(aq))として弱アルカリ性を示します。
分子構造
アンモニアの分子は、窒素原子を中心とする三角錐形を取っており、三つの水素原子と窒素上の孤立電子対から構成されています。
この構造により、アンモニアは極性分子となり、その双極子モーメントは1.42 Dです。
この極性により、アンモニアは他の極性分子と強く相互作用し、化学反応においても高い反応性を示すことが特徴です。
アンモニアの化学的性質
アンモニアは化学的には弱い塩基としての性質を持ち、さまざまな化学反応に利用されることで知られています。
その反応性の高さは、工業的な用途や実験室での試薬としての役割を支えています。
塩基性とアンモニウム塩の生成
アンモニアは塩基性を持ち、水中で部分的に電離して水酸化物イオン(OH⁻)を生成します。
この反応により、水溶液は弱アルカリ性を示します。
NH₃(aq) + H₂O(l) ↔ NH₄⁺(aq) + OH⁻(aq)
アンモニアが酸と反応すると、対応するアンモニウム塩が生成されます。
例えば、塩酸(HCl)と反応させると塩化アンモニウム(NH₄Cl)が生成され、硫酸(H₂SO₄)と反応すると硫酸アンモニウム((NH₄)₂SO₄)が生成されます。
これらのアンモニウム塩は、農業用肥料として広く利用されており、土壌中の窒素供給源として重要な役割を果たしています。
金属錯体の配位子としての利用
アンモニアは、金属錯体の配位子としても重要な化学物質です。
窒素原子上の孤立電子対は、金属イオンと強く結合する性質があり、さまざまな金属と反応して安定な錯体を形成します。
例えば、銅(II)イオン(Cu²⁺)とアンモニアは、四配位の錯体であるテトラアンミン銅(II)イオン [Cu(NH₃)₄]²⁺を形成します。
このような金属錯体の形成は、触媒反応や分析化学において非常に重要です。
アンモニアは求核性を持つため、有機化学反応においても求核剤として利用され、アミンやアミドの合成において基本的な役割を担います。
また、アンモニアはさまざまな酸化還元反応にも関与し、その反応性を利用して多くの有機化合物の合成や精製に用いられます。
液体アンモニアの特殊性
アンモニアは圧力を加えることで液化し、液体アンモニアとして利用されることがあります。
液体アンモニアは、水と似た溶媒特性を持ち、特定の物質の溶解や化学反応において特異な挙動を示します。
特に、液体アンモニア中ではアルカリ金属が容易に溶解し、青色の溶液を形成することが知られています。
この青色は、溶媒和電子によるものであり、非常に反応性が高いことが特徴です。
液体アンモニアは、金属ナトリウムを還元剤として利用する「バーチ還元」と呼ばれる有機反応にも使用されます。
この反応は、有機化学の分野で重要な手法の一つであり、液体アンモニアが持つ特殊な溶媒特性を活かした反応として知られています。

アンモニアの用途と役割
アンモニアは、現代社会における化学工業の基盤を支える重要な化合物です。
その用途は広範囲にわたり、化学工業の中核としての役割から、エネルギー資源、医薬品、食品に至るまで、多岐にわたります。
ここでは、アンモニアのさまざまな用途とその重要性について詳しく見ていきます。
化学工業でのアンモニアの利用
化学工業において、アンモニアは基礎的な化学物質として広く利用されており、その生産量は世界的にも非常に多いです。
その最も代表的な用途は、肥料の製造です。アンモニアは窒素を含むため、窒素肥料の原料として利用されます。
この肥料は、農業における作物の成長促進に不可欠であり、食糧生産の向上に直接的に貢献しています。
ハーバー・ボッシュ法による生産
アンモニアの工業的な生産方法として、ハーバー・ボッシュ法が広く採用されています。
このプロセスは、窒素(N₂)と水素(H₂)を高温(約500℃)・高圧(約200–350気圧)下で鉄触媒を用いて反応させ、アンモニアを生成するものです。
N₂ + 3H₂ → 2NH₃
ハーバー・ボッシュ法は、20世紀初頭にドイツの化学者フリッツ・ハーバーによって発明され、カール・ボッシュによって工業化されました。
この方法により、窒素肥料の大量生産が可能となり、農業の生産性が飛躍的に向上しました。
さらに、アンモニアは化学工業における基礎的な原料として、硝酸、尿素、アミン類など、さまざまな化学製品の製造に利用されています。
冷媒としてのアンモニアの利用
アンモニアは、その特性から冷媒としても広く利用されています。
液化アンモニアは、蒸発熱が大きいため、冷却システムにおいて非常に効率的な冷媒として機能します。
特に産業用冷蔵庫や冷凍装置での使用が一般的であり、オゾン層を破壊しない冷媒として環境にも優れています。
近年では、持続可能な冷却技術としてアンモニアの利用が再評価されつつあります。
エネルギー資源としてのアンモニア
アンモニアは、エネルギー資源としての可能性も注目されています。
その理由は、アンモニアが燃焼時に二酸化炭素(CO₂)を排出しないため、クリーンエネルギーの一環として利用が期待されているからです。
アンモニアの燃焼は高温で行われ、その際には窒素と水蒸気が生成されます。
火力発電用の燃料としての利用
アンモニアは、火力発電所において燃料として使用される研究が進んでいます。
特に、従来の化石燃料とアンモニアを混焼することで、CO₂排出量を削減することができるとされています。
このような技術は、既存の火力発電設備を活用しつつ、持続可能なエネルギー供給を目指す取り組みの一環として注目されています。
また、アンモニアの燃焼特性を利用して、ガスタービン発電の燃料としても利用する試みが行われており、高効率でクリーンな発電が期待されています。
水素貯蔵媒体としてのアンモニア
アンモニアは、水素エネルギーの貯蔵媒体としても重要視されています。
水素自体は、エネルギー密度が高く、クリーンエネルギーの一つとして注目されていますが、取り扱いや貯蔵が難しいという課題があります。
アンモニアは、水素よりも液化が容易であり、輸送や貯蔵の際に利便性が高いため、水素の貯蔵媒体として適しています。
さらに、アンモニアから水素を取り出す技術も研究されており、将来的には水素社会の実現における重要な役割を果たすことが期待されています。
医薬品や食品での利用
アンモニアは、医薬品や食品添加物としても利用されることがあります。
その利用範囲は、単なる工業用の物質にとどまらず、私たちの日常生活にも関わる重要な役割を担っています。
医薬品でのアンモニアの利用
医薬品の分野では、アンモニアは特定の薬品の製造過程で重要な役割を果たします。
また、アンモニア水は、虫刺されなどの外用薬としても利用されており、抗炎症効果を持つため、かゆみの軽減や炎症の抑制に効果的です。
日本薬局方の基準に従ったアンモニア水は、一部の外用薬として市販されており、日常の応急処置に役立っています。
食品添加物としてのアンモニアの利用
食品業界において、アンモニアは食品添加物としても利用されています。
特に、パンや洋菓子の製造過程では、アンモニアが膨張剤として使用されることがあります。
この場合、加熱中にアンモニアが揮発するため、最終製品には残留しません。
また、発酵食品においてもアンモニアが微量に生成されることがあり、その香りが独特の風味を生み出す要因となります。
例えば、伝統的な発酵食品である「くさや」や「ホンオフェ」などの強烈な臭いは、アンモニアが関与していることが知られています。
アンモニアはこのように、多岐にわたる用途と役割を持ち、現代社会における化学の基盤を形成する重要な物質です。
その特性を理解し、適切に活用することで、産業から日常生活に至るまで幅広い分野で貢献し続けています。
アンモニアの危険性と安全性
アンモニアは、化学工業や農業、冷却システムなどで広く利用されていますが、その毒性と取り扱いには十分な注意が必要です。
適切な対策を取らなければ、人体や環境に対するリスクが高まる可能性があるため、アンモニアの危険性を理解し、安全に取り扱うための対策を知ることが重要です。
アンモニアの毒性
アンモニアは強い刺激臭を持つため、漏洩時には比較的容易に気付くことができますが、その毒性は高いため注意が必要です。
特に高濃度のアンモニアを吸入した場合、人体に深刻な影響を及ぼすことがあります。
ここでは、アンモニアの人体への影響と急性毒性について詳しく解説します。
人体への影響
アンモニアは、低濃度でも呼吸器や粘膜に対して刺激を与えるため、目や鼻、喉に強い不快感を引き起こします。
濃度が0.5 ppm(百万分の一)程度でも、感受性の高い人は刺激を感じることがあります。
10 ppmを超えると目の痛みや喉の不快感が増し、50 ppm以上では咳や呼吸困難を引き起こすことがあります。
さらに、高濃度のアンモニア(例えば500 ppm以上)を短時間で吸入した場合、呼吸器系へのダメージが深刻となり、肺炎や肺水腫を引き起こす可能性があります。
特に、長時間の曝露や高濃度での吸入は、気管支の炎症や化学的なやけどを引き起こし、場合によっては命に関わることもあります。
また、アンモニアは皮膚にも刺激を与え、高濃度の液体アンモニアが皮膚に接触すると、化学的なやけどや凍傷を引き起こすことがあります。
急性毒性データ
以下は、動物実験に基づくアンモニアの急性毒性のデータです。
- 吸入(ラット):LC50(致死濃度50%) = 2000 ppm(4時間)
- 吸入(マウス):LC50 = 4230 ppm(4時間)
- 経口(ラット):LD50(致死量50%) = 350 mg/kg
これらのデータからもわかるように、アンモニアの毒性は濃度や曝露時間によって大きく異なります。
特に工業現場や実験室でのアンモニア取り扱いには、十分な注意と適切な防護措置が求められます。
アンモニアの取扱いと安全対策
アンモニアを安全に取り扱うためには、その特性を理解し、適切な保護具や管理手法を使用することが必要です。
また、日本ではアンモニアの取り扱いに関する規制や安全基準が定められており、それに従うことでリスクを低減することが可能です。
安全な取扱い方法
アンモニアを取り扱う際には、いくつかの基本的な安全対策があります。
まず、アンモニアが漏れた場合に備えて、十分な換気を確保することが重要です。
作業環境には強制換気装置を設置し、空気の循環を促進することで、万が一の漏洩時に濃度を低下させることができます。
また、作業者は必ず防護具を着用する必要があります。
防毒マスクやゴーグル、手袋、化学耐性のエプロンなどが推奨されており、特に高濃度のアンモニアを取り扱う場合は、完全密閉型の防護具を使用することが推奨されます。
さらに、液体アンモニアの取り扱いでは、凍傷の危険性があるため、断熱性のある手袋や防護服が必須です。
保管方法と管理
アンモニアの保管には、圧力容器を使用することが一般的です。
容器は直射日光を避け、涼しく乾燥した場所に保管することが求められます。
また、容器には耐圧試験が定期的に行われ、異常がないか確認する必要があります。
日本の規制に基づき、アンモニアの保管容器には適切な表示が義務付けられており、内容物の名称、危険性、応急処置方法などが明記されなければなりません。
日本の規制と安全基準
日本では、アンモニアの取り扱いに関して複数の法律や規制が設けられています。
例えば、「高圧ガス保安法」では、アンモニアを高圧ガスとして扱い、その製造、保管、運搬に関する安全基準を定めています。
また、「毒物及び劇物取締法」では、アンモニアは劇物に分類されており、その取扱いには専門の資格が必要です。
これらの規制に従うことで、アンモニアの漏洩や事故を未然に防ぐことが可能となります。
さらに、「悪臭防止法」に基づき、アンモニアの放出濃度には制限が設けられています。
この法律により、工場や施設から排出されるアンモニアの濃度を管理することで、周辺環境への影響を最小限に抑える取り組みが行われています。
これらの安全基準と規制に従い、アンモニアを正しく取り扱うことで、その利便性を最大限に引き出しつつ、リスクを最小限に抑えることが可能です。

アンモニアの環境への影響
アンモニアは、農業や工業で広く利用されている一方、その環境への影響には十分な注意が必要です。
自然界での循環や排出により、環境にさまざまな影響を及ぼす可能性があり、特に水質や大気質への影響は深刻です。
ここでは、アンモニアが環境にどのような影響を与えるのか、また、その影響を軽減するための対策について解説します。
環境中のアンモニアの役割
アンモニアは自然界においても生成される物質であり、窒素循環の一環として重要な役割を担っています。
アンモニアは主に動植物の分解過程で発生し、土壌や水中の微生物によって処理されることで窒素化合物として再利用されます。
しかし、人為的な活動により過剰なアンモニアが環境中に放出されると、さまざまな問題が引き起こされる可能性があります。
魚介類への影響
特に水中のアンモニア濃度が上昇すると、魚介類にとって有害な環境が形成されます。
アンモニアは水中でアンモニウムイオン(NH₄⁺)とアンモニア分子(NH₃)に分かれますが、水温やpHが高いとアンモニア分子の割合が増え、これが魚類の呼吸系や神経系に直接影響を与えます。
高濃度のアンモニアは、魚類の鰓細胞を損傷し、酸素の取り込みを妨げるため、窒息を引き起こす危険があります。
また、長期間の低濃度曝露でも成長障害や繁殖能力の低下が観察されることがあり、漁業や生態系に深刻な影響を与えることがあります。
アンモニアの大気中での役割
アンモニアは大気中にも存在し、特に農業活動による肥料からの放出が主要な原因となっています。
大気中のアンモニアは、硝酸や硫酸と反応して微小粒子状物質(PM2.5)を形成し、大気汚染の原因となります。
これらの微小粒子は健康への影響が懸念されており、呼吸器疾患や心疾患のリスクを高めることが報告されています。
さらに、アンモニアは大気中での酸性化を引き起こし、酸性雨の原因ともなり得ます。
酸性雨は土壌のpHを低下させ、植物の成長を妨げるだけでなく、水質を悪化させる要因ともなります。
アンモニアの自然循環
アンモニアは、窒素循環の一部として自然界で循環しています。
動植物が死亡した際の分解過程や、農業での肥料の使用などにより土壌や水中に放出され、そこで微生物による硝化プロセスを経て硝酸塩に変換されます。
この硝酸塩は、植物の栄養源となるだけでなく、土壌の肥沃度を高める役割を果たしています。
しかし、過剰なアンモニアの供給は、環境バランスを崩し、有害な影響を引き起こす可能性があるため、適切な管理が求められます。
脱硝技術とアンモニア
火力発電所や工業施設では、窒素酸化物(NOx)の排出が大きな問題となっています。
窒素酸化物は大気汚染や酸性雨の原因となる物質であり、その削減は環境保護の観点から非常に重要です。
ここでは、脱硝技術におけるアンモニアの役割とその効果について説明します。
選択触媒還元法(SCR法)
アンモニアは、火力発電所や工業施設での窒素酸化物削減において、選択触媒還元法(SCR法)の主要な還元剤として使用されます。
この方法では、アンモニアを窒素酸化物と反応させて無害な窒素(N₂)と水(H₂O)に変換します。
4NO + 4NH₃ + O₂ → 4N₂ + 6H₂O
SCR法は、高効率で窒素酸化物を削減できる技術であり、特に大規模な施設で広く採用されています。
この技術により、大気中への窒素酸化物の排出を大幅に削減し、環境への負荷を軽減することが可能です。
さらに、SCR法は温度範囲が広く、さまざまな種類の排ガス処理に対応できるため、柔軟な運用が可能です。
選択非触媒還元法(SNCR法)
アンモニアは、選択非触媒還元法(SNCR法)でも使用されます。
この方法は、触媒を使用せずに高温条件下でアンモニアを注入し、窒素酸化物を還元する技術です。
SNCR法は、コストが低く、設備の簡略化が可能であるため、中小規模の施設で採用されることが多いです。
ただし、反応温度が限られているため、効率がSCR法に比べてやや劣ることが課題となっています。
アンモニアの代替物質と技術の進展
近年、アンモニア以外の還元剤を使用した脱硝技術も開発されています。
例えば、尿素を還元剤として使用する「尿素SCRシステム」は、尿素を高温下で分解してアンモニアを生成し、そのアンモニアを利用して窒素酸化物を還元する方法です。
この方法は、アンモニアの取り扱いに伴う危険性を軽減することができるため、特に自動車の排ガス処理などで広く採用されています。
アンモニアは、環境保護の観点からも非常に重要な役割を果たしており、適切に管理することでその利便性を活かしつつ、環境への負荷を最小限に抑えることが可能です。
そのため、今後も技術の進展と共に、アンモニアを含む環境対策の重要性はますます増していくと考えられます。
アンモニアの生物学的側面
アンモニアは、生物の代謝において重要な役割を果たす化合物です。
しかし、高濃度のアンモニアは毒性を持つため、生物はこれを効率的に処理し、排出するためのメカニズムを進化させてきました。
ここでは、アンモニアが生体内でどのように処理され、また排出されるのかについて詳しく解説します。
生体内でのアンモニアの役割
アンモニアは、主にタンパク質やアミノ酸の代謝過程で生成される副産物です。
特に、肝臓はアンモニアの処理と排出において中心的な役割を担っています。
このアンモニアの代謝は、生命活動の維持にとって極めて重要であり、不適切な処理が行われると深刻な健康問題を引き起こす可能性があります。
肝臓でのアンモニア処理
体内で生成されたアンモニアは、肝臓で効率的に処理されます。
肝臓は、アンモニアを無毒化するために「尿素回路(オルニチン回路)」と呼ばれる一連の代謝経路を用いています。
この回路では、アンモニアはオルニチンと反応してカルバモイルリン酸を生成し、その後、シトルリンやアルギニンを経由して尿素が生成されます。
尿素は、アンモニアよりも毒性が低く、水溶性であるため、血液を通じて腎臓に運ばれ、最終的に尿として体外に排出されます。
この過程により、体内のアンモニア濃度は厳密に調整され、健康が維持されています。
肝性脳症とアンモニア
肝臓の機能が低下すると、アンモニアの処理能力が損なわれることがあります。
その結果、血中アンモニア濃度が上昇し、中枢神経系に対して有害な影響を及ぼす可能性があります。
この状態は「肝性脳症」と呼ばれ、重度の意識障害や神経症状を引き起こすことがあります。
肝性脳症は、肝硬変や肝不全などの重篤な肝疾患に関連して発生することが多く、早期の診断と治療が必要です。
治療法としては、アンモニア生成を抑制するための低タンパク質食や、腸内細菌によるアンモニア生成を抑制するための抗生物質が使用されることがあります。
生物のアンモニア排出と利用
生物は、代謝の過程で生成されるアンモニアを効率的に排出するために、さまざまな戦略を進化させてきました。
これらの排出メカニズムは、生息する環境や進化の過程によって異なり、各種生物の生理的特性に影響を与えています。
魚類と両生類のアンモニア排出
多くの魚類や水生の両生類は、アンモニアを直接排出することで代謝の副産物を処理しています。
これは「アンモニア排出型」と呼ばれ、水中での生活に適した排出方法です。
水生環境では、水がアンモニアを迅速に希釈するため、毒性を軽減することができ、この戦略が適しているのです。
魚類では、アンモニアは主に鰓(えら)を通じて直接排出されます。
水が絶えず鰓を通過することで、アンモニアが効率的に外部に放出されるため、体内でのアンモニア蓄積が防がれます。
また、両生類の幼生(オタマジャクシなど)も同様にアンモニアを直接排出することで、効率的な代謝を行っています。
陸生生物のアンモニア処理
一方で、陸生の生物は水の利用が制限されているため、アンモニアをそのまま排出することは適していません。
そのため、陸生生物はアンモニアを尿素や尿酸に変換することで、毒性を低減しつつ、水の消費を最小限に抑えた排出戦略を採用しています。
例えば、哺乳類では、アンモニアを尿素に変換して排出する「尿素排出型」のメカニズムが採用されています。
尿素は水溶性であり、比較的少量の水で体外に排出することが可能です。
また、爬虫類や鳥類はさらに効率的な「尿酸排出型」を採用しており、尿酸は水に溶けにくく、ほとんど水を使わずに固体状で排出されます。
この戦略は、乾燥した環境に適応するために進化したものであり、水の節約が生命維持において重要な要因となる場合に適しています。
アンモニアの有効利用
興味深いことに、一部の微生物はアンモニアを栄養源として利用することができます。
例えば、窒素固定細菌はアンモニアを窒素化合物として取り込み、植物が利用できる形態に変換する役割を担っています。
このプロセスは、自然界の窒素循環において重要な位置を占めており、農業における肥料の利用効率を高めるための研究にも関連しています。
また、一部の動物では、腸内細菌がアンモニアを代謝してアミノ酸や他の有機物を合成することがあります。
このような微生物との共生関係は、栄養の取得効率を高めるだけでなく、代謝物質の再利用を可能にするため、進化の過程で重要な役割を果たしてきました。

まとめ
アンモニアは、化学工業から生物学に至るまで、現代社会と自然界において非常に重要な役割を果たしています。
その用途は多岐にわたり、肥料や化学製品の原料、冷媒、さらにはエネルギー資源としての活用など、産業の基盤を支える化合物として欠かせません。
特に、ハーバー・ボッシュ法の発明は、農業の生産性を飛躍的に向上させ、世界の食糧供給に貢献しました。
また、アンモニアはクリーンエネルギー資源としても注目されており、今後の持続可能な社会の実現に向けた重要な素材となっています。
しかし、その反面、アンモニアは毒性を持ち、環境への影響にも注意が必要です。
高濃度のアンモニアは人体に有害であり、水質や大気質にも悪影響を及ぼす可能性があるため、適切な取り扱いと管理が不可欠です。
特に、火力発電所や工業施設では、アンモニアを用いた脱硝技術が環境保護の一環として導入されており、環境負荷の軽減に貢献しています。
また、生物学的な視点から見ると、アンモニアはタンパク質やアミノ酸の代謝過程で生成される不可避の副産物であり、これを効率的に処理するためのメカニズムが進化してきました。
肝臓でのアンモニア処理や、魚類が水中でアンモニアを直接排出する方法など、生物ごとに異なる戦略が採用されており、これらの生理的特性は生命の多様性を示しています。
アンモニアは、こうした多様な役割を通じて、現代社会と自然界の両方に深く関わっていることがわかります。
その利便性とリスクを理解し、適切に活用することで、産業の発展と環境保護のバランスを取ることが求められます。
今後もアンモニアに関する研究と技術の進展が進むことで、新たな利用法や安全な管理手法が開発され、さらなる社会的価値を生み出すことが期待されます。
アンモニアは、ただの化学物質ではなく、私たちの生活と環境を支える基盤の一つであり、その理解と活用が持続可能な未来の構築に向けて重要な鍵となるのです。

